Se incluyen bajo esta definición los trastornos genéticos que afectan la vía de formación del glucógeno y las de su utilización.
El glucógeno es un polisacárido formado por moléculas de glucosa unidas entre sí predominantemente por enlaces a-1- 4 y en un 7-10% por enlaces a-1,6. Estas uniones confieren a la molécula de glucógeno una estructura arbórea que permite acumular millones de moléculas de glucosa sin variación de la presión osmótica. El contenido de glucógeno es superior en el hígado que en el músculo (unos 70 mg/g de tejido y unos 15 mg/g de tejido, respectivamente). Sin embargo, este contenido fluctúa notablemente como consecuencia de la alimentación y de los estímulos hormonales. En el hígado, el glucógeno tiene como misión mantener la glucemia, y en el músculo, se utiliza para la obtención de energía (ATP) durante la contracción muscular.
La internalización de la glucosa en los tejidos requiere su fosforilación a glucosa6-fosfato (G-6-P), mediante una hexocinasa que en el hígado es específicamente una glucocinasa. La G-6-P se convierte en glucosa-1-fosfato (G-1-P) mediante la fosfoglucomutasa.
La G-1-P utilizando uridintrifosfato (UTP) y mediante la pirofosforilasa de glucosiluridildifosfato se transforma en uridindifosfato glucosa (UDPG). Seguidamente, a partir de un polímero preexistente, se van añadiendo restos de glucosa a través de enlaces 1-4 por acción de la glucógeno-sintetasa. Mediante la enzima ramificante a-1,4-glucano (a-1,4-glucano-6-glucosiltransferasa), que transfiere un oligosacárido con uniones a-1,4 a una posición a-1,6, se completa la estructura normal del glucógeno.
La degradación del glucógeno se lleva a cabo mediante dos sistemas enzimáticos: la fosforilasa y la enzima desramificante.
La fosforilasa hidroliza los enlaces a-1,4 liberando G-1-P. Esta enzima se presenta en una forma activa a, fosforilada, y una inactiva b. El paso de la forma b a la a requiere la participación de la enzima fosforilasa-b-cinasa. La enzima desramificante es una proteína bifuncional. Su actuación incluye dos pasos. En el primero transfiere tres restos de glucosa de una cadena lateral en degradación a una central (actividad de transferasa de glucano), dejando un único resto de glucosa unido a la cadena central por un enlace a-1,6. Éste es hidrolizado en un segundo paso a glucosa libre (actividad a-1,6-amilasa). Esta degradación del glucógeno se traduce en la formación de glucosa libre en un 8-10% y de G-1-P en un 90%. La G-1-P es convertida en G-6-P por acción de la fosfoglucomutasa.
Para poder ser liberada al torrente sanguíneo y de este modo mantener la glucemia, la G-6-P debe ser desfosfatada a glucosa mediante la enzima glucosa-6-fosfatasa. En el músculo, la G-1-P y la G-6-P entran en la glucólisis para la obtención de ATP durante la contracción muscular.
La regulación del metabolismo del glucógeno en el hígado se lleva a cabo a través de la concentración de glucosa extracelular. Para mantener la glucemia, el hígado actúa como dador o captador de glucosa, dependiendo de los niveles extracelulares. Las enzimas clave para la regulación son la fosforilasa y la sintetasa. Hormonas como el glucagón activan la glucogenólisis a través de una serie de reacciones en cascada que utilizan el AMPc para la activación de la fosforilasa y la inhibición de la sintetasa. Por su parte, la insulina activa la síntesis de glucógeno.
En el músculo no existe la regulación del metabolismo del glucógeno a través de la glucosa. El calcio estimula la fosforilasa b-cinasa, y es el mismo glucógeno el que actúa inhibiendo la síntesis excesiva. Al igual que en el hígado, la insulina favorece la síntesis de glucógeno.
Atendiendo a las manifestaciones clínicas, a los criterios de diagnóstico y a su tratamiento, los trastornos genéticos que afectan el metabolismo del glucógeno pueden dividirse en dos categorías: las que tienen una fisiopatología hepática hipoglucémica y las musculares. Dentro del primer grupo estarían las glucogenosis tipos Ia, Ib, III, VI y VIa, y dentro del segundo las glucogenosis tipos V, VII y los defectos de la glucólisis que no causan acumulación de glucógeno. Sin embargo,existen entidades que presentan una fisiopatología peculiar, como las glucogenosis tipos II y IV.
Si bien la nomenclatura más difundida de las glucogenosis es la de la numeración romana, existen ciertas confusiones por la asignación de diferente numeración para una mismaentidad. Por ello es recomendable nombrarlas utilizando el defecto enzimático. El uso de los nombres propios se mantiene por razones históricas.
En conjunto, la prevalencia de las glucogenosis es de 1:20.000-1:25.000, siendo los tipos I, II, III y IV los más frecuentes. Todas ellas se transmiten de forma autosómica recesiva, con excepción de la deficiencia de fosforilasa-b-cinasa que está ligada al cromosoma X.
jueves, 16 de abril de 2009
Glucogénesis
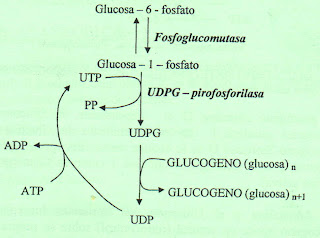
La glucogénesis, o también conocida por glucogenogenesis es la ruta anabólica por la que tiene lugar la síntesis de glucógeno (también llamado glicógeno) a partir de un precursor más simple, la glucosa-6-fosfato. Se lleva a cabo principalmente en el hígado, y en menor medida en el músculo.
Se forma por la incorporación repetida de unidades de glucosa, la que llega en forma de UDP-Glucosa a un partidor de glucógeno preexistente que consiste en la proteína glucogenina, formada por 2 cadenas, que al autoglicosilarse puede unir cada una de sus cadenas a un octámero de glucosas. Para que la glucosa-6-fosfato pueda unirse a la UDP requiere de la participación de dos enzimas, la primera consiste en una glucomutasa que modifica la posición del fosfato a glucosa-1-fosfato, con la cual interactúa la UDP fosforilaza la que cataliza la reacción entre UDP y el anterior sustrato
Síntesis
* En primer lugar, la glucosa es transformada en glucosa-6-fosfato, gastando una molécula de ATP.
o glucosa + ATP → glucosa-6-P + ADP
* A continuación se transforma la glucosa-6-fosfato en glucosa-1-fosfato con gasto de un ATP.
o glucosa-6-P ←→ glucosa-1-P
* Se transforma la glucosa-1-fosfato en UDP-glucosa, con el gasto de un UTP.
o glucosa-1-P + UTP → UDP-glucosa + PPi
* La glucógeno sintetasa va uniendo UDP-glucosa para formar el glucógeno.
o (glucosa)n + UDP-glucosa → (glucosa)n+1 + UDP
Regulación
La glucogénesis es estímulada por la hormona insulina, secretada por las células β (beta) de los islotes de Langerhans del páncreas y es inhibida por su contrarreguladora, la hormona glucagón, secretada por las células α (alfa) de los islotes de Langerhans del páncreas, que estímula la ruta catabólica llamada glucogenólisis para degradar el glucógeno almacenado y transformarlo en glucosa y así aumentar la glicemia (azúcar en sangre). En general, en condiciones hipoglicemiantes la glucogénesis será inhibida, y en casos hiperglicemiantes ocurrirá lo contrario
Glucolisis

La glucólisis o glicolisis (del griego glycos: azúcar y lysis: ruptura), es la vía metabólica encargada de oxidar o fermentar la glucosa y así obtener energía para la célula. Ésta consiste de 10 reacciones enzimáticas que convierten a la glucosa en dos moléculas de piruvato, la cual es capaz de seguir otras vías metabólicas y así continuar entregando energía al organismo.[1]
Es la vía inicial del catabolismo (degradación) de carbohidratos, y tiene tres funciones principales:
1. La generación de moléculas de alta energía (ATP y NADH) como fuente de energía celular en procesos de respiración aeróbica (presencia de oxígeno) y anaeróbica (ausencia de oxígeno).
2. La generación de piruvato que pasará al Ciclo de krebs, como parte de la respiración aeróbica.
3. La producción de intermediarios de 6 y 3 carbonos que pueden ser ocupados por otros procesos celulares.
Cuando hay ausencia de oxígeno (anoxia o hipoxia), luego que la glucosa ha pasado por este proceso, el piruvato sufre fermentación, una segunda vía de adquisición de energía que, al igual que la glucólisis, es poco eficiente. El tipo de compuesto obtenido de la fermentación suele variar con el tipo de organismo. En los animales, el piruvato fermenta a lactato y en levadura, el piruvato fermenta a etanol.
En eucariotas y procariotas, la glucólisis ocurre en el citosol de la célula. En células vegetales, algunas de las reacciones glucolíticas se encuentran también en el ciclo de Calvin, que ocurre dentro de los cloroplastos. La amplia conservación de esta vía incluye los organismos filogenéticamente más antiguos, y por esto se considera una de las vías metabólicas más antiguas.[2]
El tipo de glucólisis más común y más conocida es la vía de Embden-Meyerhoff, explicada inicialmente por Gustav Embden y Otto Meyerhof. El término puede incluir vías alternativas, como la vía de Entner-Doudoroff. No obstante, Glucólisis será usada aquí como sinónimo de la vía de Embden-Meyerhoff.
Via De Las Pentosas


La ruta de la pentosa fosfato es una ruta metabólica, en la cual se sintetizan pentosas (monosacáridos de 5 carbonos) y se genera poder reductor en forma de NADPH. La ruta se lleva a cabo en el citosol y puede dividirse en dos fases, la fase oxidativa, en que se genera NADPH, y la fase no oxidativa en que se sintetizan pentosas-fosfato (y otros monosacáridos-fosfato). Esta ruta es una de las tres principales vías en que se crea poder reductor (aproximadamente un 10% en humanos).
Fase oxidativa
En esta fase, dos moléculas de NADP+ son reducidas a NADPH utilizando la energía de la conversión de glucosa-6-fosfato en ribulosa-5-fosfato, según la reacción,El NADPH que es usado en la síntesis de ácidos grasos y colesterol, reacciones de hidroxilación de neurotransmisores, detoxificación de peróxidos de hidrógeno, así como en el mantenimiento del glutation en su forma reducida.
Fase no oxidativa
A partir de la ribulosa-5-fosfato se sintetiza xilulosa-5-fosfato y ribosa-5-fosfato monosacárido imprescindible para la síntesis de nucleósidos, nucleótidos y por ende de ácidos nucléicos. El resto de monosacáridos pueden tener diferentes usos, tanto biosintéticos como energéticos (glucólisis).
ciclo de krebs

El ciclo de Krebs (también llamado ciclo del ácido cítrico o ciclo de los ácidos tricarboxílicos) es una ruta metabólica, es decir, una sucesión de reacciones químicas, que forman parte de la respiración celular en todas las células aerobias. En organismos aeróbicos, el ciclo de Krebs es parte de la vía catabólica que realiza la oxidación de hidratos de carbono, ácidos grasos y aminoácidos hasta producir CO2, liberando energía en forma utilizable (poder reductor y GTP).
El metabolismo oxidativo de glúcidos, grasas y proteínas frecuentemente se divide en tres etapas, de las cuales el ciclo de Krebs supone la segunda. En la primera etapa los carbonos de estas macromoléculas dan lugar a moléculas de acetil-CoA de dos carbonos, e incluye las vías catabólicas de aminoácidos (p. ej. desaminación oxidativa), la beta oxidación de ácidos grasos y la glucólisis. La tercera etapa es la fosforilación oxidativa, en la cual el poder reductor (NADH y FADH2) generado se emplea para la síntesis de ATP según la teoría del acomplamiento quimiosmótico.
El ciclo de Krebs también proporciona precursores para muchas biomoléculas, como ciertos aminoácidos. Por ello se considera una vía anfibólica, es decir, catabólica y anabólica al mismo tiempo.
Suscribirse a:
Entradas (Atom)