Se incluyen bajo esta definición los trastornos genéticos que afectan la vía de formación del glucógeno y las de su utilización.
El glucógeno es un polisacárido formado por moléculas de glucosa unidas entre sí predominantemente por enlaces a-1- 4 y en un 7-10% por enlaces a-1,6. Estas uniones confieren a la molécula de glucógeno una estructura arbórea que permite acumular millones de moléculas de glucosa sin variación de la presión osmótica. El contenido de glucógeno es superior en el hígado que en el músculo (unos 70 mg/g de tejido y unos 15 mg/g de tejido, respectivamente). Sin embargo, este contenido fluctúa notablemente como consecuencia de la alimentación y de los estímulos hormonales. En el hígado, el glucógeno tiene como misión mantener la glucemia, y en el músculo, se utiliza para la obtención de energía (ATP) durante la contracción muscular.
La internalización de la glucosa en los tejidos requiere su fosforilación a glucosa6-fosfato (G-6-P), mediante una hexocinasa que en el hígado es específicamente una glucocinasa. La G-6-P se convierte en glucosa-1-fosfato (G-1-P) mediante la fosfoglucomutasa.
La G-1-P utilizando uridintrifosfato (UTP) y mediante la pirofosforilasa de glucosiluridildifosfato se transforma en uridindifosfato glucosa (UDPG). Seguidamente, a partir de un polímero preexistente, se van añadiendo restos de glucosa a través de enlaces 1-4 por acción de la glucógeno-sintetasa. Mediante la enzima ramificante a-1,4-glucano (a-1,4-glucano-6-glucosiltransferasa), que transfiere un oligosacárido con uniones a-1,4 a una posición a-1,6, se completa la estructura normal del glucógeno.
La degradación del glucógeno se lleva a cabo mediante dos sistemas enzimáticos: la fosforilasa y la enzima desramificante.
La fosforilasa hidroliza los enlaces a-1,4 liberando G-1-P. Esta enzima se presenta en una forma activa a, fosforilada, y una inactiva b. El paso de la forma b a la a requiere la participación de la enzima fosforilasa-b-cinasa. La enzima desramificante es una proteína bifuncional. Su actuación incluye dos pasos. En el primero transfiere tres restos de glucosa de una cadena lateral en degradación a una central (actividad de transferasa de glucano), dejando un único resto de glucosa unido a la cadena central por un enlace a-1,6. Éste es hidrolizado en un segundo paso a glucosa libre (actividad a-1,6-amilasa). Esta degradación del glucógeno se traduce en la formación de glucosa libre en un 8-10% y de G-1-P en un 90%. La G-1-P es convertida en G-6-P por acción de la fosfoglucomutasa.
Para poder ser liberada al torrente sanguíneo y de este modo mantener la glucemia, la G-6-P debe ser desfosfatada a glucosa mediante la enzima glucosa-6-fosfatasa. En el músculo, la G-1-P y la G-6-P entran en la glucólisis para la obtención de ATP durante la contracción muscular.
La regulación del metabolismo del glucógeno en el hígado se lleva a cabo a través de la concentración de glucosa extracelular. Para mantener la glucemia, el hígado actúa como dador o captador de glucosa, dependiendo de los niveles extracelulares. Las enzimas clave para la regulación son la fosforilasa y la sintetasa. Hormonas como el glucagón activan la glucogenólisis a través de una serie de reacciones en cascada que utilizan el AMPc para la activación de la fosforilasa y la inhibición de la sintetasa. Por su parte, la insulina activa la síntesis de glucógeno.
En el músculo no existe la regulación del metabolismo del glucógeno a través de la glucosa. El calcio estimula la fosforilasa b-cinasa, y es el mismo glucógeno el que actúa inhibiendo la síntesis excesiva. Al igual que en el hígado, la insulina favorece la síntesis de glucógeno.
Atendiendo a las manifestaciones clínicas, a los criterios de diagnóstico y a su tratamiento, los trastornos genéticos que afectan el metabolismo del glucógeno pueden dividirse en dos categorías: las que tienen una fisiopatología hepática hipoglucémica y las musculares. Dentro del primer grupo estarían las glucogenosis tipos Ia, Ib, III, VI y VIa, y dentro del segundo las glucogenosis tipos V, VII y los defectos de la glucólisis que no causan acumulación de glucógeno. Sin embargo,existen entidades que presentan una fisiopatología peculiar, como las glucogenosis tipos II y IV.
Si bien la nomenclatura más difundida de las glucogenosis es la de la numeración romana, existen ciertas confusiones por la asignación de diferente numeración para una mismaentidad. Por ello es recomendable nombrarlas utilizando el defecto enzimático. El uso de los nombres propios se mantiene por razones históricas.
En conjunto, la prevalencia de las glucogenosis es de 1:20.000-1:25.000, siendo los tipos I, II, III y IV los más frecuentes. Todas ellas se transmiten de forma autosómica recesiva, con excepción de la deficiencia de fosforilasa-b-cinasa que está ligada al cromosoma X.
jueves, 16 de abril de 2009
Glucogénesis
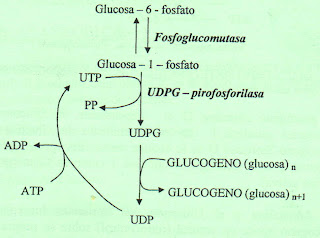
La glucogénesis, o también conocida por glucogenogenesis es la ruta anabólica por la que tiene lugar la síntesis de glucógeno (también llamado glicógeno) a partir de un precursor más simple, la glucosa-6-fosfato. Se lleva a cabo principalmente en el hígado, y en menor medida en el músculo.
Se forma por la incorporación repetida de unidades de glucosa, la que llega en forma de UDP-Glucosa a un partidor de glucógeno preexistente que consiste en la proteína glucogenina, formada por 2 cadenas, que al autoglicosilarse puede unir cada una de sus cadenas a un octámero de glucosas. Para que la glucosa-6-fosfato pueda unirse a la UDP requiere de la participación de dos enzimas, la primera consiste en una glucomutasa que modifica la posición del fosfato a glucosa-1-fosfato, con la cual interactúa la UDP fosforilaza la que cataliza la reacción entre UDP y el anterior sustrato
Síntesis
* En primer lugar, la glucosa es transformada en glucosa-6-fosfato, gastando una molécula de ATP.
o glucosa + ATP → glucosa-6-P + ADP
* A continuación se transforma la glucosa-6-fosfato en glucosa-1-fosfato con gasto de un ATP.
o glucosa-6-P ←→ glucosa-1-P
* Se transforma la glucosa-1-fosfato en UDP-glucosa, con el gasto de un UTP.
o glucosa-1-P + UTP → UDP-glucosa + PPi
* La glucógeno sintetasa va uniendo UDP-glucosa para formar el glucógeno.
o (glucosa)n + UDP-glucosa → (glucosa)n+1 + UDP
Regulación
La glucogénesis es estímulada por la hormona insulina, secretada por las células β (beta) de los islotes de Langerhans del páncreas y es inhibida por su contrarreguladora, la hormona glucagón, secretada por las células α (alfa) de los islotes de Langerhans del páncreas, que estímula la ruta catabólica llamada glucogenólisis para degradar el glucógeno almacenado y transformarlo en glucosa y así aumentar la glicemia (azúcar en sangre). En general, en condiciones hipoglicemiantes la glucogénesis será inhibida, y en casos hiperglicemiantes ocurrirá lo contrario
Glucolisis

La glucólisis o glicolisis (del griego glycos: azúcar y lysis: ruptura), es la vía metabólica encargada de oxidar o fermentar la glucosa y así obtener energía para la célula. Ésta consiste de 10 reacciones enzimáticas que convierten a la glucosa en dos moléculas de piruvato, la cual es capaz de seguir otras vías metabólicas y así continuar entregando energía al organismo.[1]
Es la vía inicial del catabolismo (degradación) de carbohidratos, y tiene tres funciones principales:
1. La generación de moléculas de alta energía (ATP y NADH) como fuente de energía celular en procesos de respiración aeróbica (presencia de oxígeno) y anaeróbica (ausencia de oxígeno).
2. La generación de piruvato que pasará al Ciclo de krebs, como parte de la respiración aeróbica.
3. La producción de intermediarios de 6 y 3 carbonos que pueden ser ocupados por otros procesos celulares.
Cuando hay ausencia de oxígeno (anoxia o hipoxia), luego que la glucosa ha pasado por este proceso, el piruvato sufre fermentación, una segunda vía de adquisición de energía que, al igual que la glucólisis, es poco eficiente. El tipo de compuesto obtenido de la fermentación suele variar con el tipo de organismo. En los animales, el piruvato fermenta a lactato y en levadura, el piruvato fermenta a etanol.
En eucariotas y procariotas, la glucólisis ocurre en el citosol de la célula. En células vegetales, algunas de las reacciones glucolíticas se encuentran también en el ciclo de Calvin, que ocurre dentro de los cloroplastos. La amplia conservación de esta vía incluye los organismos filogenéticamente más antiguos, y por esto se considera una de las vías metabólicas más antiguas.[2]
El tipo de glucólisis más común y más conocida es la vía de Embden-Meyerhoff, explicada inicialmente por Gustav Embden y Otto Meyerhof. El término puede incluir vías alternativas, como la vía de Entner-Doudoroff. No obstante, Glucólisis será usada aquí como sinónimo de la vía de Embden-Meyerhoff.
Via De Las Pentosas


La ruta de la pentosa fosfato es una ruta metabólica, en la cual se sintetizan pentosas (monosacáridos de 5 carbonos) y se genera poder reductor en forma de NADPH. La ruta se lleva a cabo en el citosol y puede dividirse en dos fases, la fase oxidativa, en que se genera NADPH, y la fase no oxidativa en que se sintetizan pentosas-fosfato (y otros monosacáridos-fosfato). Esta ruta es una de las tres principales vías en que se crea poder reductor (aproximadamente un 10% en humanos).
Fase oxidativa
En esta fase, dos moléculas de NADP+ son reducidas a NADPH utilizando la energía de la conversión de glucosa-6-fosfato en ribulosa-5-fosfato, según la reacción,El NADPH que es usado en la síntesis de ácidos grasos y colesterol, reacciones de hidroxilación de neurotransmisores, detoxificación de peróxidos de hidrógeno, así como en el mantenimiento del glutation en su forma reducida.
Fase no oxidativa
A partir de la ribulosa-5-fosfato se sintetiza xilulosa-5-fosfato y ribosa-5-fosfato monosacárido imprescindible para la síntesis de nucleósidos, nucleótidos y por ende de ácidos nucléicos. El resto de monosacáridos pueden tener diferentes usos, tanto biosintéticos como energéticos (glucólisis).
ciclo de krebs

El ciclo de Krebs (también llamado ciclo del ácido cítrico o ciclo de los ácidos tricarboxílicos) es una ruta metabólica, es decir, una sucesión de reacciones químicas, que forman parte de la respiración celular en todas las células aerobias. En organismos aeróbicos, el ciclo de Krebs es parte de la vía catabólica que realiza la oxidación de hidratos de carbono, ácidos grasos y aminoácidos hasta producir CO2, liberando energía en forma utilizable (poder reductor y GTP).
El metabolismo oxidativo de glúcidos, grasas y proteínas frecuentemente se divide en tres etapas, de las cuales el ciclo de Krebs supone la segunda. En la primera etapa los carbonos de estas macromoléculas dan lugar a moléculas de acetil-CoA de dos carbonos, e incluye las vías catabólicas de aminoácidos (p. ej. desaminación oxidativa), la beta oxidación de ácidos grasos y la glucólisis. La tercera etapa es la fosforilación oxidativa, en la cual el poder reductor (NADH y FADH2) generado se emplea para la síntesis de ATP según la teoría del acomplamiento quimiosmótico.
El ciclo de Krebs también proporciona precursores para muchas biomoléculas, como ciertos aminoácidos. Por ello se considera una vía anfibólica, es decir, catabólica y anabólica al mismo tiempo.
domingo, 1 de marzo de 2009
prueba con imagen
TEMA 2
HIDRATOS DE CARBONO
1. Definición y clasificación
2. Estructura tridimensional de los monosacáridos
3. Reacciones de ciclación de los monosacáridos
4. Reacciones de oxidación-reducción
5. Reacción de formación de enlaces O-glucosídicos
6. Disacáridos
7. Polisacáridos
8. Funciones fisiológicas de los carbohidratos
1. Definición y clasificación
Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) son compuestos esenciales de los organismos vivos y son la clase más abundante de moléculas biológicas. El nombre carbohidratos significa literalmente hidratos de carbono y proviene de su composición química, que para muchos de ellos es (C•H2O)n , donde n 3. Es decir, son compuestos en los que n átomos de carbono parecen estar hidratados con n moléculas de agua. En realidad se trata de polihidroxialdehidos y polihidrohicetonas (y algunos derivados de éstos), cadenas de carbono que contienen un grupo aldehído o cetónico y varios grupos hidroxilos (Figura 1).
. (Figura 2).
2. Monosacáridos
Los monosacáridos se clasifican según la naturaleza química de su grupo carbonilo y del número de átomos de carbono que poseen.
Atendiendo a la naturaleza química del grupo funcional carbonílico, si éste es aldehído el monosacárido recibe el nombre genérico de aldosa, y si es cetónico el monosacárido se le designa como cetosa. Dependiendo del número de átomos de carbono de la molécula, los monosacáridos se denominan triosas, tetrosas, pentosas, hexosas, etc. cuando contienen tres, cuatro, cinco, seis, etc. átomos de carbono. Se conocen en la naturaleza monosacáridos de hasta 8 átomos de carbono.
La combinación de ambas nomenclaturas anteriores permite denominar con el término aldohexosa a un azúcar (-osa) de seis átomos de carbono (-hex-), cuyo carbono carbonílico es una aldosa (aldo-). Por ejemplo, la glucosa.
El gliceraldehido es la aldosa más simple. Está formado por tres átomos de carbono, el primero contiene el grupo aldehído, el segundo tiene unido un hidrógeno y un grupo hidroxilo, mientras que el tercero posee dos hidrógenos y un hidroxilo. De los tres carbonos, el segundo (C-2) posee los cuatros sustituyentes distintos y por esta característica recibe el nombre de carbono asimétrico o quiral. Este hecho hace que el gliceraldehido exista en dos estructuras espaciales que se diferencian por cierta propiedad física (actividad óptica): una tiene el hidroxilo del C-2 hacia la derecha (D-gliceraldehido) y la otra posee el hidroxilo del C-2 hacia la izquierda (L-gliceradehido).
Las moléculas que aún teniendo la misma composición química tienen diferentes propiedades se denominan isómeros. A isómeros que se diferencian por la disposición espacial de los grupos sustituyentes de un centro quiral se les conoce con el nombre de isómeros ópticos o estereoisómeros. Dichos isómeros ópticos presentan una propiedad física denominada actividad óptica. La actividad óptica es la capacidad que tienen las moléculas quirales, en disolución, de desviar el plano de un haz de luz polarizada. Si lo hacen en el sentido de las manecillas del reloj, se designan con el símbolo (+) y si lo hacen en sentido contrario se designan con (-). Así, el enantiómero D- del gliceraldehido es (+) y el L- es (-). Esto no quiere decir que todos los monosacáridos de la serie D tengan que ser (+). Por un lado está la posición del grupo hidroxilo (-OH) respecto a su carbono quiral, que es un aspecto puramente estructural, y por otro el efecto de la estructura de la molécula sobre el haz de luz polarizada, que es producido por la interacción de los rayos de luz polarizada con la red cristalina de la molécula en disolución. Por la configuración de los sustituyentes de los carbonos quirales no es posible asignar a un carbohidrato actividad óptica (+) ó (-).
Cuando los isómeros ópticos son imágenes especulares no superponibles se denominan enantiómeros, como es el caso del D y L gliceraldehido (Figura 4). Aquellos isómeros ópticos que se diferencian solo en la configuración de uno de sus carbonos quirales se denominan epímeros. El resto de isómeros ópticos que no son enantiómeros ni epímeros se denominan diastereómeros.
Los monosacáridos se clasifican en la serie D- o en la serie L- de acuerdo con la configuración del carbono quiral más alejado del grupo carbonilo. Así, si dicho carbono posee la misma configuración que el carbono quiral del D-gliceraldehido, pertenece a la serie D-.
En la Figura 5 se recogen las aldosas de la serie D-. Como se observa podemos construirlas adicionando unidades de H-C-OH ó de HO-C-H inmediatamente por debajo del carbono carbonílico. Lógicamente existirá otra familia de la serie L- con las imágenes especulares de las aldosas de esta Figura. En total tendremos 2 aldotriosas, 4 aldotetrosas, 8 aldopentosas y 16 aldohexosas.
En las cetosas el grupo carbonilo ocupa la posición 2 en la cadena carbonada. La cetosa más pequeña es la dihidroxiacetona:
Lo primero que salta a la vista es que esta cetosa carece de carbono quiral, luego, a diferencia de las aldosas, sólo existe una ceto-triosa y carece de actividad óptica. De ella se continúa la familia con la Eritrulosa, la cual sí posee enantiómeros D- y L-, ya que el carbono 3 es quiral (posee 4 sustituyentes distintos). La Figura 6 muestra las cetosas de la serie D-. Existen 1 cetotriosa, 2 cetotetrosas, 4 cetopentosas y 8 cetohexosas. De todas ellas la cetosa más común es la D-fructosa, cuyo nombre se le asignó antes de conocer su estructura; el resto de cetosas se aislaron o sintetizaron a partir de las aldosas y se las denominan basándose en el nombre de su aldosa de origen. Así, la D-fructosa, debería llamarse D-arabinohexulosa, ya que posee el esqueleto base de la D-arabinosa.
3. Reacciones de ciclación de los monosacáridos
La presencia de cinco o de seis carbonos en la cadena proporciona a estos compuestos la posibilidad de formar estructuras de anillo muy estables mediante la formación de un enlace hemiacetal interno, en el caso de las aldosas, o un hemicetal interno si son cetosas.. La formación de la estructura cíclica se produce de la misma manera que los alcoholes reaccionan con los grupos carbonilo de aldehídos o las cetonas.
El grupo hidroxilo de un monosacárido puede reaccionar con su correspondiente grupo carbonilo (aldo- o ceto-) para dar lugar a hemiacetales o hemicetales cíclicos. Este tipo de procesos se puede representar mediante las fórmulas de proyección de Haworth. Las proyecciones derivadas de aldosas de seis carbonos dan lugar a anillos derivados de pirano y las derivadas de cetosas de seis carbonos originan anillos derivados de furano (Figura 8).
Así, por ejemplo, la D-Glucosa se cicla por reacción del hidroxilo del carbono 5 (C-5) con el grupo carbonilo del aldehido, dando lugar a un anillo hexagonal de piranosa, por similitud con el anillo de pirano (Figura 9).
Un aspecto importante del proceso es que al formarse el correspondiente hemiacetal, el C-1 de la glucosa (que inicialmente era no quiral) se transforma en un carbono quiral (con 4 sustituyentes distintos). Este nuevo carbono quiral recibe el nombre de anomérico (*), y da lugar a dos estructuras denominadas anómeros, uno con el grupo hidroxilo del C-1 por debajo del anillo, anómero , y el otro con el grupo hidroxilo por encima del anillo, anómero ß. Así, por ciclación de la D-glucosa obtenemos los hemiacetales -D-glucopiranosa y la ß-D-glucopiranosa.
-D-glucopiranosa D-glucosa -D-glucopiranosa
De la misma manera la D-fructosa se cicla por reacción del hidroxilo del carbono 5, con el carbonilo que ocupa la posición 2, dando lugar, en este caso, a un anillo de furanosa (por similitud con el anillo de furano), con dos anómeros; uno sería la -D-fructofuranosa y el otro la ß-D-fructofuranosa.
anillo de furano -D-fructofuranosa D-fructosa ß-D-fructofuranosa.
En general, las hexosas y las pentosas pueden adoptar la forma de pirano o furano dependiendo de la naturaleza del azúcar. Es importante indicar que en disolución acuosa existe un equilibrio entre la forma abierta y los anillos ciclados. De tal manera que la D-glucosa se presentaría en equilibrio entre su anómeros y .
4. Reacciones de oxidación-reducción
La oxidación de los monosacáridos puede producirse de diversas formas, según el agente oxidante utilizado. Así, la oxidación suave de una aldosa con Cu (II) produce los ácidos aldónicos, como en el ejemplo recogido en la Figura 10.
La reducción de aldosas en atmósfera de hidrógeno produce alditoles (polialcoholes). Así, la reducción de la glucosa conlleva la reducción del grupo carbonilo de naturaleza aldehídica para rendir un polialcohol conocido como sorbitol.
5. Reacción de formación de enlaces O-glucosídicos
Una de las reacciones más importantes de los monosacáridos es la reacción del carbono anomérico (del anillo de piranosa o furanosa) con un alcohol para producir un glucósido. El nuevo enlace que se forma recibe el nombre de enlace glucosídico. Así, la ß-D-glucopiranosa puede reaccionar con el etanol para dar el siguiente glucósido:
que recibe el nombre de ß-D-metil-glucopiranósido (se cambia la terminación -osa por -ósido).
La importancia de este proceso radica en que el enlace glucosídico se forma también por reacción del hidroxilo del carbono anomérico de un monosacárido con un grupo hidroxilo de otro monosacárido, dando lugar a un disacárido. Los oligosacáridos y los polisacáridos son el resultado de la unión de monosacáridos mediante este tipo de enlace.
En general este tipo de compuestos se conocen con el nombre de O-glucósidos (el oxigeno hace de puente en el enlace). Además existen otros glucósidos, de gran importancia en la naturaleza: se trata de los N-glucósidos, en los que el C anomérico reacciona con una amina. Tiene gran importancia en la formación de nucleósidos, entre ellos la adenosina es el más abundante, que forma parte del trifosfato de adenosina (ATP), y de los ácidos ribonucleicos.
6. Los Disacáridos
Son dímeros formados por dos moléculas de monosacáridos, iguales o diferentes, unidas mediante enlace glucosídico. Este enlace puede realizarse de dos formas distintas; tomemos como ejemplo la glucosa.
i) ii)
En el primer caso, i), los dos monosacáridos están unidos mediante enlace O-glucosídico del tipo (1-4); como se puede apreciar, el disacárido formado presenta un carbono anomérico (*) libre (en el anillo segundo). En el caso ii) la unión se establece a través de los carbonos anoméricos de ambos monosacáridos; en este caso, el enlace glucosídico es del tipo (1-1), bloqueando los dos carbonos anoméricos (*).
La Figura 11 muestra algunos disacáridos abundantes, la sacarosa, la lactosa, la maltosa y la trealosa. Vamos a analizar químicamente la lactosa y la sacarosa. La lactosa es el ß-D-galactopioranosil-(1-4)-ß-D-glucopiranosido, y la sacarosa es el -D-glucopiranosil-(1-2)-ß-D-fructofuranosido. La lactosa posee un enlace glucosídico ß-(1-4), mientras que en la sacarosa es del tipo (1-2)ß. Este aspecto es muy importante si se analizan sus propiedades químicas. Así, la lactosa al poseer un carbono anomérico libre (el C-1 de la glucosa), en disolución, puede abrirse y poner de manifiesto la naturaleza reductora de este disacárido. Por su parte la sacarosa, no posee carbono anomérico libre, los dos están formando parte del enlace glucosídico, ninguno de los anillos puede abrirse y pierde su capacidad reductora. Por esta razón se dice que la lactosa es un azúcar reductor y la sacarosa no.
7. Polisacáridos
Son polímeros de monosacáridos unidos por enlace O-glucosídico. Entre los polímeros naturales, algunos de los más abundantes y de mayor significativo biológico son el almidón, el glucógeno y la celulosa. Los tres están formados por moléculas de D-glucosa y sólo se diferencian en el tipo de enlace glucosídico, constituyendo estructuras espaciales diferentes.
• El almidón
Es la principal reserva de hidratos de carbono que sintetizan las plantas y es también la principal fuente de glucosa para la alimentación de los animales. Está formado por una mezcla de dos polisacáridos, la amilosa (en un 20 %) y la amilopectina (en un 80 %). La amilosa es un polímero lineal de D-glucosa con uniones -(1-4) glucosídicas (Figura 12), que le permite adoptar una disposición tridimensional de tipo helicoidal (Figura 13).
Por su parte, la amilopectina está constituida por restos de D-glucosa unidos por enlace -(1-4), pero presenta también ramificaciones cada 24-30 unidades de glucosa, mediante enlaces -(1-6) (Figura 13).
• El Glucógeno
El glucógeno es el polisacárido de reserva de glucosa en los animales y constituye el equivalente al almidón en las células vegetales. Se halla presente en todas las células, aunque preferentemente se acumula en los músculos esqueléticos y especialmente en el hígado (10 % en peso), en cuyas células el glucógeno aparece en forma de grandes gránulos. La estructura principal del glucógeno se parece a la amilopectina, posee una cadena líneal con uniones -(1-4) y ramificaciones -(1-6), aunque en este caso aparecen cada 8 ó 12 unidades de glucosa (Figura 15). El glucógeno (al igual que el almidón) se hidroliza con facilidad por la acción de las -amilasas (proteínas especializadas en la rotura del enlace -glucosídico).
• La celulosa
La celulosa, componente estructural primario de las paredes de las células vegetales, es un polímero lineal de glucosa unido por enlaces ß-(1-4) glucosídicos (Figura 16). A diferencia de la amilosa (helicoidal y con uniones ), el enlace ß impide que la molécula se enrolle, de forma que las cadenas de celulosa pueden adoptan una conformación plenamente extendida permitiendo que se empaqueten con facilidad mediante puentes de hidrógeno, lo que explica su resistencia y su insolubilidad en agua. A diferencia de los casos anteriores, los vertebrados no poseen enzimas capaces de hidrolizar el enlace ß-(1-4), sólo los herbívoros poseen microorganismos simbióticos con una enzima (celulasa) que permite hidrolizar los enlaces ß-(1-4) glucosídicos.
Otro polisacárido de gran abundancia en la naturaleza es la quitina, que es el principal componente estructural de los esqueletos de los invertebrados. La quitina es un polímero constituido por restos N-acetil-D-glucosamina unidos por enlace ß-(1-4). Se diferencia de la celulosa sólo en el sustituyente del C-2, que posee, en lugar de un -OH, una acetamida. De relevancia son también otros polisacáridos como la heparina, polisacárido heterogéneo natural compuesto por D-iduronato-2-sulfato unidos por enlace glucosídico (1-4) a N-sulfo-D-glucosamina-6-sulfato (Figura 17). Se utiliza en medicina por su poder anticoagulante. El ácido hialurónico es otro heteropolímero constituido por dímeros de ácido glucurónico y N-acetilglucosamina (Figura 18). Está presente en los fluídos sinoviales de las articulaciones donde desempeña su función protectora contra golpes, basada en su valor lubrificante y su alta viscosidad.
8. Funciones fisiológicas de los carbohidratos
Algunos monosacáridos como la glucosa y sus derivados, son piezas fundamentales de muchas rutas metabólicas esenciales para la obtención de energía . La glucosa actúa en el organismo como combustible energético de uso rápido, mientras polisacáridos o grasas son reservas energéticas que deben ser procesadas antes de su utilización. Algunos monosacáridos y disacáridos como la fructosa o la sacarosa son responsables del sabor dulce de muchos frutos, con lo que se hacen más atractivos a los agentes dispersantes de las semillas.
Los oligosacáridos, pequeñas cadenas poliméricas conteniendo entre 2 y 10 monosacáridos, aparecen normalmente formando parte de las glicoproteínas que ejercen importantes funciones reguladoras o de reconocimiento celular.
Los polisacáridos como almidón o glucógeno tienen funciones de reserva energética en plantas y animales, respectivamente. Otros polisacáridos tienen funciones estructurales. Ya hemos citado el caso de la celulosa, principal componente de las paredes celulares vegetales, que supone la mayor parte de la masa de la madera y el algodón en casi pura celulosa; y la quitina, principal componente del exoesqueleto de muchos artrópodos. También tienen gran importancia estructural el heteropolímero de residuos alternados de N-acetilglucosamina y N-acetilmurámico unidos por enlaces 1-4), que constituyen el componente principal de las paredes celulares bacterianas; estos heteropolímeros se unen a proteinas formando peptidoglucanos.
HIDRATOS DE CARBONO
1. Definición y clasificación
2. Estructura tridimensional de los monosacáridos
3. Reacciones de ciclación de los monosacáridos
4. Reacciones de oxidación-reducción
5. Reacción de formación de enlaces O-glucosídicos
6. Disacáridos
7. Polisacáridos
8. Funciones fisiológicas de los carbohidratos
1. Definición y clasificación
Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) son compuestos esenciales de los organismos vivos y son la clase más abundante de moléculas biológicas. El nombre carbohidratos significa literalmente hidratos de carbono y proviene de su composición química, que para muchos de ellos es (C•H2O)n , donde n 3. Es decir, son compuestos en los que n átomos de carbono parecen estar hidratados con n moléculas de agua. En realidad se trata de polihidroxialdehidos y polihidrohicetonas (y algunos derivados de éstos), cadenas de carbono que contienen un grupo aldehído o cetónico y varios grupos hidroxilos (Figura 1).
. (Figura 2).
2. Monosacáridos
Los monosacáridos se clasifican según la naturaleza química de su grupo carbonilo y del número de átomos de carbono que poseen.
Atendiendo a la naturaleza química del grupo funcional carbonílico, si éste es aldehído el monosacárido recibe el nombre genérico de aldosa, y si es cetónico el monosacárido se le designa como cetosa. Dependiendo del número de átomos de carbono de la molécula, los monosacáridos se denominan triosas, tetrosas, pentosas, hexosas, etc. cuando contienen tres, cuatro, cinco, seis, etc. átomos de carbono. Se conocen en la naturaleza monosacáridos de hasta 8 átomos de carbono.
La combinación de ambas nomenclaturas anteriores permite denominar con el término aldohexosa a un azúcar (-osa) de seis átomos de carbono (-hex-), cuyo carbono carbonílico es una aldosa (aldo-). Por ejemplo, la glucosa.
El gliceraldehido es la aldosa más simple. Está formado por tres átomos de carbono, el primero contiene el grupo aldehído, el segundo tiene unido un hidrógeno y un grupo hidroxilo, mientras que el tercero posee dos hidrógenos y un hidroxilo. De los tres carbonos, el segundo (C-2) posee los cuatros sustituyentes distintos y por esta característica recibe el nombre de carbono asimétrico o quiral. Este hecho hace que el gliceraldehido exista en dos estructuras espaciales que se diferencian por cierta propiedad física (actividad óptica): una tiene el hidroxilo del C-2 hacia la derecha (D-gliceraldehido) y la otra posee el hidroxilo del C-2 hacia la izquierda (L-gliceradehido).
Las moléculas que aún teniendo la misma composición química tienen diferentes propiedades se denominan isómeros. A isómeros que se diferencian por la disposición espacial de los grupos sustituyentes de un centro quiral se les conoce con el nombre de isómeros ópticos o estereoisómeros. Dichos isómeros ópticos presentan una propiedad física denominada actividad óptica. La actividad óptica es la capacidad que tienen las moléculas quirales, en disolución, de desviar el plano de un haz de luz polarizada. Si lo hacen en el sentido de las manecillas del reloj, se designan con el símbolo (+) y si lo hacen en sentido contrario se designan con (-). Así, el enantiómero D- del gliceraldehido es (+) y el L- es (-). Esto no quiere decir que todos los monosacáridos de la serie D tengan que ser (+). Por un lado está la posición del grupo hidroxilo (-OH) respecto a su carbono quiral, que es un aspecto puramente estructural, y por otro el efecto de la estructura de la molécula sobre el haz de luz polarizada, que es producido por la interacción de los rayos de luz polarizada con la red cristalina de la molécula en disolución. Por la configuración de los sustituyentes de los carbonos quirales no es posible asignar a un carbohidrato actividad óptica (+) ó (-).
Cuando los isómeros ópticos son imágenes especulares no superponibles se denominan enantiómeros, como es el caso del D y L gliceraldehido (Figura 4). Aquellos isómeros ópticos que se diferencian solo en la configuración de uno de sus carbonos quirales se denominan epímeros. El resto de isómeros ópticos que no son enantiómeros ni epímeros se denominan diastereómeros.
Los monosacáridos se clasifican en la serie D- o en la serie L- de acuerdo con la configuración del carbono quiral más alejado del grupo carbonilo. Así, si dicho carbono posee la misma configuración que el carbono quiral del D-gliceraldehido, pertenece a la serie D-.
En la Figura 5 se recogen las aldosas de la serie D-. Como se observa podemos construirlas adicionando unidades de H-C-OH ó de HO-C-H inmediatamente por debajo del carbono carbonílico. Lógicamente existirá otra familia de la serie L- con las imágenes especulares de las aldosas de esta Figura. En total tendremos 2 aldotriosas, 4 aldotetrosas, 8 aldopentosas y 16 aldohexosas.
En las cetosas el grupo carbonilo ocupa la posición 2 en la cadena carbonada. La cetosa más pequeña es la dihidroxiacetona:
Lo primero que salta a la vista es que esta cetosa carece de carbono quiral, luego, a diferencia de las aldosas, sólo existe una ceto-triosa y carece de actividad óptica. De ella se continúa la familia con la Eritrulosa, la cual sí posee enantiómeros D- y L-, ya que el carbono 3 es quiral (posee 4 sustituyentes distintos). La Figura 6 muestra las cetosas de la serie D-. Existen 1 cetotriosa, 2 cetotetrosas, 4 cetopentosas y 8 cetohexosas. De todas ellas la cetosa más común es la D-fructosa, cuyo nombre se le asignó antes de conocer su estructura; el resto de cetosas se aislaron o sintetizaron a partir de las aldosas y se las denominan basándose en el nombre de su aldosa de origen. Así, la D-fructosa, debería llamarse D-arabinohexulosa, ya que posee el esqueleto base de la D-arabinosa.
3. Reacciones de ciclación de los monosacáridos
La presencia de cinco o de seis carbonos en la cadena proporciona a estos compuestos la posibilidad de formar estructuras de anillo muy estables mediante la formación de un enlace hemiacetal interno, en el caso de las aldosas, o un hemicetal interno si son cetosas.. La formación de la estructura cíclica se produce de la misma manera que los alcoholes reaccionan con los grupos carbonilo de aldehídos o las cetonas.
El grupo hidroxilo de un monosacárido puede reaccionar con su correspondiente grupo carbonilo (aldo- o ceto-) para dar lugar a hemiacetales o hemicetales cíclicos. Este tipo de procesos se puede representar mediante las fórmulas de proyección de Haworth. Las proyecciones derivadas de aldosas de seis carbonos dan lugar a anillos derivados de pirano y las derivadas de cetosas de seis carbonos originan anillos derivados de furano (Figura 8).
Así, por ejemplo, la D-Glucosa se cicla por reacción del hidroxilo del carbono 5 (C-5) con el grupo carbonilo del aldehido, dando lugar a un anillo hexagonal de piranosa, por similitud con el anillo de pirano (Figura 9).
Un aspecto importante del proceso es que al formarse el correspondiente hemiacetal, el C-1 de la glucosa (que inicialmente era no quiral) se transforma en un carbono quiral (con 4 sustituyentes distintos). Este nuevo carbono quiral recibe el nombre de anomérico (*), y da lugar a dos estructuras denominadas anómeros, uno con el grupo hidroxilo del C-1 por debajo del anillo, anómero , y el otro con el grupo hidroxilo por encima del anillo, anómero ß. Así, por ciclación de la D-glucosa obtenemos los hemiacetales -D-glucopiranosa y la ß-D-glucopiranosa.
-D-glucopiranosa D-glucosa -D-glucopiranosa
De la misma manera la D-fructosa se cicla por reacción del hidroxilo del carbono 5, con el carbonilo que ocupa la posición 2, dando lugar, en este caso, a un anillo de furanosa (por similitud con el anillo de furano), con dos anómeros; uno sería la -D-fructofuranosa y el otro la ß-D-fructofuranosa.
anillo de furano -D-fructofuranosa D-fructosa ß-D-fructofuranosa.
En general, las hexosas y las pentosas pueden adoptar la forma de pirano o furano dependiendo de la naturaleza del azúcar. Es importante indicar que en disolución acuosa existe un equilibrio entre la forma abierta y los anillos ciclados. De tal manera que la D-glucosa se presentaría en equilibrio entre su anómeros y .
4. Reacciones de oxidación-reducción
La oxidación de los monosacáridos puede producirse de diversas formas, según el agente oxidante utilizado. Así, la oxidación suave de una aldosa con Cu (II) produce los ácidos aldónicos, como en el ejemplo recogido en la Figura 10.
La reducción de aldosas en atmósfera de hidrógeno produce alditoles (polialcoholes). Así, la reducción de la glucosa conlleva la reducción del grupo carbonilo de naturaleza aldehídica para rendir un polialcohol conocido como sorbitol.
5. Reacción de formación de enlaces O-glucosídicos
Una de las reacciones más importantes de los monosacáridos es la reacción del carbono anomérico (del anillo de piranosa o furanosa) con un alcohol para producir un glucósido. El nuevo enlace que se forma recibe el nombre de enlace glucosídico. Así, la ß-D-glucopiranosa puede reaccionar con el etanol para dar el siguiente glucósido:
que recibe el nombre de ß-D-metil-glucopiranósido (se cambia la terminación -osa por -ósido).
La importancia de este proceso radica en que el enlace glucosídico se forma también por reacción del hidroxilo del carbono anomérico de un monosacárido con un grupo hidroxilo de otro monosacárido, dando lugar a un disacárido. Los oligosacáridos y los polisacáridos son el resultado de la unión de monosacáridos mediante este tipo de enlace.
En general este tipo de compuestos se conocen con el nombre de O-glucósidos (el oxigeno hace de puente en el enlace). Además existen otros glucósidos, de gran importancia en la naturaleza: se trata de los N-glucósidos, en los que el C anomérico reacciona con una amina. Tiene gran importancia en la formación de nucleósidos, entre ellos la adenosina es el más abundante, que forma parte del trifosfato de adenosina (ATP), y de los ácidos ribonucleicos.
6. Los Disacáridos
Son dímeros formados por dos moléculas de monosacáridos, iguales o diferentes, unidas mediante enlace glucosídico. Este enlace puede realizarse de dos formas distintas; tomemos como ejemplo la glucosa.
i) ii)
En el primer caso, i), los dos monosacáridos están unidos mediante enlace O-glucosídico del tipo (1-4); como se puede apreciar, el disacárido formado presenta un carbono anomérico (*) libre (en el anillo segundo). En el caso ii) la unión se establece a través de los carbonos anoméricos de ambos monosacáridos; en este caso, el enlace glucosídico es del tipo (1-1), bloqueando los dos carbonos anoméricos (*).
La Figura 11 muestra algunos disacáridos abundantes, la sacarosa, la lactosa, la maltosa y la trealosa. Vamos a analizar químicamente la lactosa y la sacarosa. La lactosa es el ß-D-galactopioranosil-(1-4)-ß-D-glucopiranosido, y la sacarosa es el -D-glucopiranosil-(1-2)-ß-D-fructofuranosido. La lactosa posee un enlace glucosídico ß-(1-4), mientras que en la sacarosa es del tipo (1-2)ß. Este aspecto es muy importante si se analizan sus propiedades químicas. Así, la lactosa al poseer un carbono anomérico libre (el C-1 de la glucosa), en disolución, puede abrirse y poner de manifiesto la naturaleza reductora de este disacárido. Por su parte la sacarosa, no posee carbono anomérico libre, los dos están formando parte del enlace glucosídico, ninguno de los anillos puede abrirse y pierde su capacidad reductora. Por esta razón se dice que la lactosa es un azúcar reductor y la sacarosa no.
7. Polisacáridos
Son polímeros de monosacáridos unidos por enlace O-glucosídico. Entre los polímeros naturales, algunos de los más abundantes y de mayor significativo biológico son el almidón, el glucógeno y la celulosa. Los tres están formados por moléculas de D-glucosa y sólo se diferencian en el tipo de enlace glucosídico, constituyendo estructuras espaciales diferentes.
• El almidón
Es la principal reserva de hidratos de carbono que sintetizan las plantas y es también la principal fuente de glucosa para la alimentación de los animales. Está formado por una mezcla de dos polisacáridos, la amilosa (en un 20 %) y la amilopectina (en un 80 %). La amilosa es un polímero lineal de D-glucosa con uniones -(1-4) glucosídicas (Figura 12), que le permite adoptar una disposición tridimensional de tipo helicoidal (Figura 13).
Por su parte, la amilopectina está constituida por restos de D-glucosa unidos por enlace -(1-4), pero presenta también ramificaciones cada 24-30 unidades de glucosa, mediante enlaces -(1-6) (Figura 13).
• El Glucógeno
El glucógeno es el polisacárido de reserva de glucosa en los animales y constituye el equivalente al almidón en las células vegetales. Se halla presente en todas las células, aunque preferentemente se acumula en los músculos esqueléticos y especialmente en el hígado (10 % en peso), en cuyas células el glucógeno aparece en forma de grandes gránulos. La estructura principal del glucógeno se parece a la amilopectina, posee una cadena líneal con uniones -(1-4) y ramificaciones -(1-6), aunque en este caso aparecen cada 8 ó 12 unidades de glucosa (Figura 15). El glucógeno (al igual que el almidón) se hidroliza con facilidad por la acción de las -amilasas (proteínas especializadas en la rotura del enlace -glucosídico).
• La celulosa
La celulosa, componente estructural primario de las paredes de las células vegetales, es un polímero lineal de glucosa unido por enlaces ß-(1-4) glucosídicos (Figura 16). A diferencia de la amilosa (helicoidal y con uniones ), el enlace ß impide que la molécula se enrolle, de forma que las cadenas de celulosa pueden adoptan una conformación plenamente extendida permitiendo que se empaqueten con facilidad mediante puentes de hidrógeno, lo que explica su resistencia y su insolubilidad en agua. A diferencia de los casos anteriores, los vertebrados no poseen enzimas capaces de hidrolizar el enlace ß-(1-4), sólo los herbívoros poseen microorganismos simbióticos con una enzima (celulasa) que permite hidrolizar los enlaces ß-(1-4) glucosídicos.
Otro polisacárido de gran abundancia en la naturaleza es la quitina, que es el principal componente estructural de los esqueletos de los invertebrados. La quitina es un polímero constituido por restos N-acetil-D-glucosamina unidos por enlace ß-(1-4). Se diferencia de la celulosa sólo en el sustituyente del C-2, que posee, en lugar de un -OH, una acetamida. De relevancia son también otros polisacáridos como la heparina, polisacárido heterogéneo natural compuesto por D-iduronato-2-sulfato unidos por enlace glucosídico (1-4) a N-sulfo-D-glucosamina-6-sulfato (Figura 17). Se utiliza en medicina por su poder anticoagulante. El ácido hialurónico es otro heteropolímero constituido por dímeros de ácido glucurónico y N-acetilglucosamina (Figura 18). Está presente en los fluídos sinoviales de las articulaciones donde desempeña su función protectora contra golpes, basada en su valor lubrificante y su alta viscosidad.
8. Funciones fisiológicas de los carbohidratos
Algunos monosacáridos como la glucosa y sus derivados, son piezas fundamentales de muchas rutas metabólicas esenciales para la obtención de energía . La glucosa actúa en el organismo como combustible energético de uso rápido, mientras polisacáridos o grasas son reservas energéticas que deben ser procesadas antes de su utilización. Algunos monosacáridos y disacáridos como la fructosa o la sacarosa son responsables del sabor dulce de muchos frutos, con lo que se hacen más atractivos a los agentes dispersantes de las semillas.
Los oligosacáridos, pequeñas cadenas poliméricas conteniendo entre 2 y 10 monosacáridos, aparecen normalmente formando parte de las glicoproteínas que ejercen importantes funciones reguladoras o de reconocimiento celular.
Los polisacáridos como almidón o glucógeno tienen funciones de reserva energética en plantas y animales, respectivamente. Otros polisacáridos tienen funciones estructurales. Ya hemos citado el caso de la celulosa, principal componente de las paredes celulares vegetales, que supone la mayor parte de la masa de la madera y el algodón en casi pura celulosa; y la quitina, principal componente del exoesqueleto de muchos artrópodos. También tienen gran importancia estructural el heteropolímero de residuos alternados de N-acetilglucosamina y N-acetilmurámico unidos por enlaces 1-4), que constituyen el componente principal de las paredes celulares bacterianas; estos heteropolímeros se unen a proteinas formando peptidoglucanos.
los carbohidratos o sacaridos ( del griego : sakcharon, azucar )son compuestos esenciales de los organismos vivos y son la clase mas abundante de moleculas biologicas el nombre carbohidratos significa literalmente hidratos de carbono y proviene de su composicion quimica que para muchos es ( C H 2 O )n donde n es mayor oigual a tres es decir son compuestos en los que n atomos de carbono parecen estar hidratados con n moleculas de agua en realidad se trata de polihidroxialdehidos y polihidrohicetonas ( y algunos derivados de estos ) , cadenas de carbono que contienen un grupo aldehido o cetonico y varios grupos hidroxilos.
Los monosacaridos se clasifican segun la naturaleza quimica de su grupo carbonilo y del numero de atomos que poseen.
Atendiendo a la naturaleza quimicadel grupo funcional carbonilico, si este es aldehido el monosacarido recibe el nombre generico de aldosa y si es cetonico el monosacarido se le designa como cetosa dependiendo del numero de atomos de carbonos de la celula los monosacaridos se denominan , triosas, tetrosas,pentosas,hexosas cuando contienen tres, cuatro, cinco seis etc. atomos de carbono . se conocen en la naturaleza monosacaridos de hasta 8 atomos de carbono. La combinacion de ambas nomenclaturas anteriores permite denominar con el termino aldoexosa a un azucar ( -osa) de seis atomos de carbono ( -hex-) cuyo carbono carbonilico es una aldosa ( aldo-) por ejemplo la glucosa .
El gliceraldehido es la aldosa mas simple . Esta formado por tres atomos de carbono, el primero tiene el grupo aldehido, el segundo tiene unido un hidrogeno y un grupo hidroxilo, mientras que el tercero posee dos hidrogenos y un hidroxilo, de los tres carbonos el segundo ( -2 ) posee los cuatro sustituyentes distintos y por esta caracteristica recibe el nombre de carbono asimetrico o quiral. Este hecho hace que el gliceraldehido exista en dos estructuras espaciales que se diferencian por cierta propiedad fisica ( actividad optica ): una tiene el hidroxilo del C-2 hacia la izquierda ( L- gliceraldehido ).
las moleculas que aun teniendo la misma composicion quimica tienen diferentes propiedades se denominan isomeros. A isomeros que se diferencian por la disposicion espacial de los grupos sustituyentes de un centro quiral se les conoce con el nombre de isomeros opticos o estereoisomeros dichos isomeros opticos presentan una propiedad fisica denominada actividad optica es la capacidad que tienen las moleculas quirales, en disolucion de desviar el plano de un haz de luz polarizado. si lo hacen en el sentido de las manecillas del reloj se designan con el simbolo ( +) y el L- es (- ) esto no quiere decir que todos los monosacaridos de la serie D tenga que ser ( + ) por un lado esta la posicion del grupo hidroxilo (- OH) respecto a su carbono quiral que es un aspecto puramente estructural y por otroel efecto de la estructura de la molecula sobre el haz de luz polarizada que es producido por la interaccion de los rayos de luz polarizada con la red cristalina de la molecula en disolucion por la configuracion de los sustituyentes de los carbonos quirales no es posible asignar a un candidato actividad optica ( + ) o (- ) Cuando los isomeros opticos son imagenes especulares no superponibles se denominan enantiomeros, como es el caso del D y L gliceraldehido.
Aquellos isomeros opticos que se diferencian solo en la configuracion
TEMA 2
HIDRATOS DE CARBONO
1. Definición y clasificación
2. Estructura tridimensional de los monosacáridos
3. Reacciones de ciclación de los monosacáridos
4. Reacciones de oxidación-reducción
5. Reacción de formación de enlaces O-glucosídicos
6. Disacáridos
7. Polisacáridos
8. Funciones fisiológicas de los carbohidratos
1. Definición y clasificación
Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) son compuestos esenciales de los organismos vivos y son la clase más abundante de moléculas biológicas. El nombre carbohidratos significa literalmente hidratos de carbono y proviene de su composición química, que para muchos de ellos es (C•H2O)n , donde n 3. Es decir, son compuestos en los que n átomos de carbono parecen estar hidratados con n moléculas de agua. En realidad se trata de polihidroxialdehidos y polihidrohicetonas (y algunos derivados de éstos), cadenas de carbono que contienen un grupo aldehído o cetónico y varios grupos hidroxilos (Figura 1).
. (Figura 2).
2. Monosacáridos
Los monosacáridos se clasifican según la naturaleza química de su grupo carbonilo y del número de átomos de carbono que poseen.
Atendiendo a la naturaleza química del grupo funcional carbonílico, si éste es aldehído el monosacárido recibe el nombre genérico de aldosa, y si es cetónico el monosacárido se le designa como cetosa. Dependiendo del número de átomos de carbono de la molécula, los monosacáridos se denominan triosas, tetrosas, pentosas, hexosas, etc. cuando contienen tres, cuatro, cinco, seis, etc. átomos de carbono. Se conocen en la naturaleza monosacáridos de hasta 8 átomos de carbono.
La combinación de ambas nomenclaturas anteriores permite denominar con el término aldohexosa a un azúcar (-osa) de seis átomos de carbono (-hex-), cuyo carbono carbonílico es una aldosa (aldo-). Por ejemplo, la glucosa.
El gliceraldehido es la aldosa más simple. Está formado por tres átomos de carbono, el primero contiene el grupo aldehído, el segundo tiene unido un hidrógeno y un grupo hidroxilo, mientras que el tercero posee dos hidrógenos y un hidroxilo. De los tres carbonos, el segundo (C-2) posee los cuatros sustituyentes distintos y por esta característica recibe el nombre de carbono asimétrico o quiral. Este hecho hace que el gliceraldehido exista en dos estructuras espaciales que se diferencian por cierta propiedad física (actividad óptica): una tiene el hidroxilo del C-2 hacia la derecha (D-gliceraldehido) y la otra posee el hidroxilo del C-2 hacia la izquierda (L-gliceradehido).
Las moléculas que aún teniendo la misma composición química tienen diferentes propiedades se denominan isómeros. A isómeros que se diferencian por la disposición espacial de los grupos sustituyentes de un centro quiral se les conoce con el nombre de isómeros ópticos o estereoisómeros. Dichos isómeros ópticos presentan una propiedad física denominada actividad óptica. La actividad óptica es la capacidad que tienen las moléculas quirales, en disolución, de desviar el plano de un haz de luz polarizada. Si lo hacen en el sentido de las manecillas del reloj, se designan con el símbolo (+) y si lo hacen en sentido contrario se designan con (-). Así, el enantiómero D- del gliceraldehido es (+) y el L- es (-). Esto no quiere decir que todos los monosacáridos de la serie D tengan que ser (+). Por un lado está la posición del grupo hidroxilo (-OH) respecto a su carbono quiral, que es un aspecto puramente estructural, y por otro el efecto de la estructura de la molécula sobre el haz de luz polarizada, que es producido por la interacción de los rayos de luz polarizada con la red cristalina de la molécula en disolución. Por la configuración de los sustituyentes de los carbonos quirales no es posible asignar a un carbohidrato actividad óptica (+) ó (-).
Cuando los isómeros ópticos son imágenes especulares no superponibles se denominan enantiómeros, como es el caso del D y L gliceraldehido (Figura 4). Aquellos isómeros ópticos que se diferencian solo en la configuración de uno de sus carbonos quirales se denominan epímeros. El resto de isómeros ópticos que no son enantiómeros ni epímeros se denominan diastereómeros.
Los monosacáridos se clasifican en la serie D- o en la serie L- de acuerdo con la configuración del carbono quiral más alejado del grupo carbonilo. Así, si dicho carbono posee la misma configuración que el carbono quiral del D-gliceraldehido, pertenece a la serie D-.
En la Figura 5 se recogen las aldosas de la serie D-. Como se observa podemos construirlas adicionando unidades de H-C-OH ó de HO-C-H inmediatamente por debajo del carbono carbonílico. Lógicamente existirá otra familia de la serie L- con las imágenes especulares de las aldosas de esta Figura. En total tendremos 2 aldotriosas, 4 aldotetrosas, 8 aldopentosas y 16 aldohexosas.
En las cetosas el grupo carbonilo ocupa la posición 2 en la cadena carbonada. La cetosa más pequeña es la dihidroxiacetona:
Lo primero que salta a la vista es que esta cetosa carece de carbono quiral, luego, a diferencia de las aldosas, sólo existe una ceto-triosa y carece de actividad óptica. De ella se continúa la familia con la Eritrulosa, la cual sí posee enantiómeros D- y L-, ya que el carbono 3 es quiral (posee 4 sustituyentes distintos). La Figura 6 muestra las cetosas de la serie D-. Existen 1 cetotriosa, 2 cetotetrosas, 4 cetopentosas y 8 cetohexosas. De todas ellas la cetosa más común es la D-fructosa, cuyo nombre se le asignó antes de conocer su estructura; el resto de cetosas se aislaron o sintetizaron a partir de las aldosas y se las denominan basándose en el nombre de su aldosa de origen. Así, la D-fructosa, debería llamarse D-arabinohexulosa, ya que posee el esqueleto base de la D-arabinosa.
3. Reacciones de ciclación de los monosacáridos
La presencia de cinco o de seis carbonos en la cadena proporciona a estos compuestos la posibilidad de formar estructuras de anillo muy estables mediante la formación de un enlace hemiacetal interno, en el caso de las aldosas, o un hemicetal interno si son cetosas.. La formación de la estructura cíclica se produce de la misma manera que los alcoholes reaccionan con los grupos carbonilo de aldehídos o las cetonas.
El grupo hidroxilo de un monosacárido puede reaccionar con su correspondiente grupo carbonilo (aldo- o ceto-) para dar lugar a hemiacetales o hemicetales cíclicos. Este tipo de procesos se puede representar mediante las fórmulas de proyección de Haworth. Las proyecciones derivadas de aldosas de seis carbonos dan lugar a anillos derivados de pirano y las derivadas de cetosas de seis carbonos originan anillos derivados de furano (Figura 8).
Así, por ejemplo, la D-Glucosa se cicla por reacción del hidroxilo del carbono 5 (C-5) con el grupo carbonilo del aldehido, dando lugar a un anillo hexagonal de piranosa, por similitud con el anillo de pirano (Figura 9).
Un aspecto importante del proceso es que al formarse el correspondiente hemiacetal, el C-1 de la glucosa (que inicialmente era no quiral) se transforma en un carbono quiral (con 4 sustituyentes distintos). Este nuevo carbono quiral recibe el nombre de anomérico (*), y da lugar a dos estructuras denominadas anómeros, uno con el grupo hidroxilo del C-1 por debajo del anillo, anómero , y el otro con el grupo hidroxilo por encima del anillo, anómero ß. Así, por ciclación de la D-glucosa obtenemos los hemiacetales -D-glucopiranosa y la ß-D-glucopiranosa.
-D-glucopiranosa D-glucosa -D-glucopiranosa
De la misma manera la D-fructosa se cicla por reacción del hidroxilo del carbono 5, con el carbonilo que ocupa la posición 2, dando lugar, en este caso, a un anillo de furanosa (por similitud con el anillo de furano), con dos anómeros; uno sería la -D-fructofuranosa y el otro la ß-D-fructofuranosa.
anillo de furano -D-fructofuranosa D-fructosa ß-D-fructofuranosa.
En general, las hexosas y las pentosas pueden adoptar la forma de pirano o furano dependiendo de la naturaleza del azúcar. Es importante indicar que en disolución acuosa existe un equilibrio entre la forma abierta y los anillos ciclados. De tal manera que la D-glucosa se presentaría en equilibrio entre su anómeros y .
4. Reacciones de oxidación-reducción
La oxidación de los monosacáridos puede producirse de diversas formas, según el agente oxidante utilizado. Así, la oxidación suave de una aldosa con Cu (II) produce los ácidos aldónicos, como en el ejemplo recogido en la Figura 10.
La reducción de aldosas en atmósfera de hidrógeno produce alditoles (polialcoholes). Así, la reducción de la glucosa conlleva la reducción del grupo carbonilo de naturaleza aldehídica para rendir un polialcohol conocido como sorbitol.
5. Reacción de formación de enlaces O-glucosídicos
Una de las reacciones más importantes de los monosacáridos es la reacción del carbono anomérico (del anillo de piranosa o furanosa) con un alcohol para producir un glucósido. El nuevo enlace que se forma recibe el nombre de enlace glucosídico. Así, la ß-D-glucopiranosa puede reaccionar con el etanol para dar el siguiente glucósido:
que recibe el nombre de ß-D-metil-glucopiranósido (se cambia la terminación -osa por -ósido).
La importancia de este proceso radica en que el enlace glucosídico se forma también por reacción del hidroxilo del carbono anomérico de un monosacárido con un grupo hidroxilo de otro monosacárido, dando lugar a un disacárido. Los oligosacáridos y los polisacáridos son el resultado de la unión de monosacáridos mediante este tipo de enlace.
En general este tipo de compuestos se conocen con el nombre de O-glucósidos (el oxigeno hace de puente en el enlace). Además existen otros glucósidos, de gran importancia en la naturaleza: se trata de los N-glucósidos, en los que el C anomérico reacciona con una amina. Tiene gran importancia en la formación de nucleósidos, entre ellos la adenosina es el más abundante, que forma parte del trifosfato de adenosina (ATP), y de los ácidos ribonucleicos.
6. Los Disacáridos
Son dímeros formados por dos moléculas de monosacáridos, iguales o diferentes, unidas mediante enlace glucosídico. Este enlace puede realizarse de dos formas distintas; tomemos como ejemplo la glucosa.
i) ii)
En el primer caso, i), los dos monosacáridos están unidos mediante enlace O-glucosídico del tipo (1-4); como se puede apreciar, el disacárido formado presenta un carbono anomérico (*) libre (en el anillo segundo). En el caso ii) la unión se establece a través de los carbonos anoméricos de ambos monosacáridos; en este caso, el enlace glucosídico es del tipo (1-1), bloqueando los dos carbonos anoméricos (*).
La Figura 11 muestra algunos disacáridos abundantes, la sacarosa, la lactosa, la maltosa y la trealosa. Vamos a analizar químicamente la lactosa y la sacarosa. La lactosa es el ß-D-galactopioranosil-(1-4)-ß-D-glucopiranosido, y la sacarosa es el -D-glucopiranosil-(1-2)-ß-D-fructofuranosido. La lactosa posee un enlace glucosídico ß-(1-4), mientras que en la sacarosa es del tipo (1-2)ß. Este aspecto es muy importante si se analizan sus propiedades químicas. Así, la lactosa al poseer un carbono anomérico libre (el C-1 de la glucosa), en disolución, puede abrirse y poner de manifiesto la naturaleza reductora de este disacárido. Por su parte la sacarosa, no posee carbono anomérico libre, los dos están formando parte del enlace glucosídico, ninguno de los anillos puede abrirse y pierde su capacidad reductora. Por esta razón se dice que la lactosa es un azúcar reductor y la sacarosa no.
7. Polisacáridos
Son polímeros de monosacáridos unidos por enlace O-glucosídico. Entre los polímeros naturales, algunos de los más abundantes y de mayor significativo biológico son el almidón, el glucógeno y la celulosa. Los tres están formados por moléculas de D-glucosa y sólo se diferencian en el tipo de enlace glucosídico, constituyendo estructuras espaciales diferentes.
• El almidón
Es la principal reserva de hidratos de carbono que sintetizan las plantas y es también la principal fuente de glucosa para la alimentación de los animales. Está formado por una mezcla de dos polisacáridos, la amilosa (en un 20 %) y la amilopectina (en un 80 %). La amilosa es un polímero lineal de D-glucosa con uniones -(1-4) glucosídicas (Figura 12), que le permite adoptar una disposición tridimensional de tipo helicoidal (Figura 13).
Por su parte, la amilopectina está constituida por restos de D-glucosa unidos por enlace -(1-4), pero presenta también ramificaciones cada 24-30 unidades de glucosa, mediante enlaces -(1-6) (Figura 13).
• El Glucógeno
El glucógeno es el polisacárido de reserva de glucosa en los animales y constituye el equivalente al almidón en las células vegetales. Se halla presente en todas las células, aunque preferentemente se acumula en los músculos esqueléticos y especialmente en el hígado (10 % en peso), en cuyas células el glucógeno aparece en forma de grandes gránulos. La estructura principal del glucógeno se parece a la amilopectina, posee una cadena líneal con uniones -(1-4) y ramificaciones -(1-6), aunque en este caso aparecen cada 8 ó 12 unidades de glucosa (Figura 15). El glucógeno (al igual que el almidón) se hidroliza con facilidad por la acción de las -amilasas (proteínas especializadas en la rotura del enlace -glucosídico).
• La celulosa
La celulosa, componente estructural primario de las paredes de las células vegetales, es un polímero lineal de glucosa unido por enlaces ß-(1-4) glucosídicos (Figura 16). A diferencia de la amilosa (helicoidal y con uniones ), el enlace ß impide que la molécula se enrolle, de forma que las cadenas de celulosa pueden adoptan una conformación plenamente extendida permitiendo que se empaqueten con facilidad mediante puentes de hidrógeno, lo que explica su resistencia y su insolubilidad en agua. A diferencia de los casos anteriores, los vertebrados no poseen enzimas capaces de hidrolizar el enlace ß-(1-4), sólo los herbívoros poseen microorganismos simbióticos con una enzima (celulasa) que permite hidrolizar los enlaces ß-(1-4) glucosídicos.
Otro polisacárido de gran abundancia en la naturaleza es la quitina, que es el principal componente estructural de los esqueletos de los invertebrados. La quitina es un polímero constituido por restos N-acetil-D-glucosamina unidos por enlace ß-(1-4). Se diferencia de la celulosa sólo en el sustituyente del C-2, que posee, en lugar de un -OH, una acetamida. De relevancia son también otros polisacáridos como la heparina, polisacárido heterogéneo natural compuesto por D-iduronato-2-sulfato unidos por enlace glucosídico (1-4) a N-sulfo-D-glucosamina-6-sulfato (Figura 17). Se utiliza en medicina por su poder anticoagulante. El ácido hialurónico es otro heteropolímero constituido por dímeros de ácido glucurónico y N-acetilglucosamina (Figura 18). Está presente en los fluídos sinoviales de las articulaciones donde desempeña su función protectora contra golpes, basada en su valor lubrificante y su alta viscosidad.
8. Funciones fisiológicas de los carbohidratos
Algunos monosacáridos como la glucosa y sus derivados, son piezas fundamentales de muchas rutas metabólicas esenciales para la obtención de energía . La glucosa actúa en el organismo como combustible energético de uso rápido, mientras polisacáridos o grasas son reservas energéticas que deben ser procesadas antes de su utilización. Algunos monosacáridos y disacáridos como la fructosa o la sacarosa son responsables del sabor dulce de muchos frutos, con lo que se hacen más atractivos a los agentes dispersantes de las semillas.
Los oligosacáridos, pequeñas cadenas poliméricas conteniendo entre 2 y 10 monosacáridos, aparecen normalmente formando parte de las glicoproteínas que ejercen importantes funciones reguladoras o de reconocimiento celular.
Los polisacáridos como almidón o glucógeno tienen funciones de reserva energética en plantas y animales, respectivamente. Otros polisacáridos tienen funciones estructurales. Ya hemos citado el caso de la celulosa, principal componente de las paredes celulares vegetales, que supone la mayor parte de la masa de la madera y el algodón en casi pura celulosa; y la quitina, principal componente del exoesqueleto de muchos artrópodos. También tienen gran importancia estructural el heteropolímero de residuos alternados de N-acetilglucosamina y N-acetilmurámico unidos por enlaces 1-4), que constituyen el componente principal de las paredes celulares bacterianas; estos heteropolímeros se unen a proteinas formando peptidoglucanos.
Los monosacaridos se clasifican segun la naturaleza quimica de su grupo carbonilo y del numero de atomos que poseen.
Atendiendo a la naturaleza quimicadel grupo funcional carbonilico, si este es aldehido el monosacarido recibe el nombre generico de aldosa y si es cetonico el monosacarido se le designa como cetosa dependiendo del numero de atomos de carbonos de la celula los monosacaridos se denominan , triosas, tetrosas,pentosas,hexosas cuando contienen tres, cuatro, cinco seis etc. atomos de carbono . se conocen en la naturaleza monosacaridos de hasta 8 atomos de carbono. La combinacion de ambas nomenclaturas anteriores permite denominar con el termino aldoexosa a un azucar ( -osa) de seis atomos de carbono ( -hex-) cuyo carbono carbonilico es una aldosa ( aldo-) por ejemplo la glucosa .
El gliceraldehido es la aldosa mas simple . Esta formado por tres atomos de carbono, el primero tiene el grupo aldehido, el segundo tiene unido un hidrogeno y un grupo hidroxilo, mientras que el tercero posee dos hidrogenos y un hidroxilo, de los tres carbonos el segundo ( -2 ) posee los cuatro sustituyentes distintos y por esta caracteristica recibe el nombre de carbono asimetrico o quiral. Este hecho hace que el gliceraldehido exista en dos estructuras espaciales que se diferencian por cierta propiedad fisica ( actividad optica ): una tiene el hidroxilo del C-2 hacia la izquierda ( L- gliceraldehido ).
las moleculas que aun teniendo la misma composicion quimica tienen diferentes propiedades se denominan isomeros. A isomeros que se diferencian por la disposicion espacial de los grupos sustituyentes de un centro quiral se les conoce con el nombre de isomeros opticos o estereoisomeros dichos isomeros opticos presentan una propiedad fisica denominada actividad optica es la capacidad que tienen las moleculas quirales, en disolucion de desviar el plano de un haz de luz polarizado. si lo hacen en el sentido de las manecillas del reloj se designan con el simbolo ( +) y el L- es (- ) esto no quiere decir que todos los monosacaridos de la serie D tenga que ser ( + ) por un lado esta la posicion del grupo hidroxilo (- OH) respecto a su carbono quiral que es un aspecto puramente estructural y por otroel efecto de la estructura de la molecula sobre el haz de luz polarizada que es producido por la interaccion de los rayos de luz polarizada con la red cristalina de la molecula en disolucion por la configuracion de los sustituyentes de los carbonos quirales no es posible asignar a un candidato actividad optica ( + ) o (- ) Cuando los isomeros opticos son imagenes especulares no superponibles se denominan enantiomeros, como es el caso del D y L gliceraldehido.
Aquellos isomeros opticos que se diferencian solo en la configuracion
TEMA 2
HIDRATOS DE CARBONO
1. Definición y clasificación
2. Estructura tridimensional de los monosacáridos
3. Reacciones de ciclación de los monosacáridos
4. Reacciones de oxidación-reducción
5. Reacción de formación de enlaces O-glucosídicos
6. Disacáridos
7. Polisacáridos
8. Funciones fisiológicas de los carbohidratos
1. Definición y clasificación
Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) son compuestos esenciales de los organismos vivos y son la clase más abundante de moléculas biológicas. El nombre carbohidratos significa literalmente hidratos de carbono y proviene de su composición química, que para muchos de ellos es (C•H2O)n , donde n 3. Es decir, son compuestos en los que n átomos de carbono parecen estar hidratados con n moléculas de agua. En realidad se trata de polihidroxialdehidos y polihidrohicetonas (y algunos derivados de éstos), cadenas de carbono que contienen un grupo aldehído o cetónico y varios grupos hidroxilos (Figura 1).
. (Figura 2).
2. Monosacáridos
Los monosacáridos se clasifican según la naturaleza química de su grupo carbonilo y del número de átomos de carbono que poseen.
Atendiendo a la naturaleza química del grupo funcional carbonílico, si éste es aldehído el monosacárido recibe el nombre genérico de aldosa, y si es cetónico el monosacárido se le designa como cetosa. Dependiendo del número de átomos de carbono de la molécula, los monosacáridos se denominan triosas, tetrosas, pentosas, hexosas, etc. cuando contienen tres, cuatro, cinco, seis, etc. átomos de carbono. Se conocen en la naturaleza monosacáridos de hasta 8 átomos de carbono.
La combinación de ambas nomenclaturas anteriores permite denominar con el término aldohexosa a un azúcar (-osa) de seis átomos de carbono (-hex-), cuyo carbono carbonílico es una aldosa (aldo-). Por ejemplo, la glucosa.
El gliceraldehido es la aldosa más simple. Está formado por tres átomos de carbono, el primero contiene el grupo aldehído, el segundo tiene unido un hidrógeno y un grupo hidroxilo, mientras que el tercero posee dos hidrógenos y un hidroxilo. De los tres carbonos, el segundo (C-2) posee los cuatros sustituyentes distintos y por esta característica recibe el nombre de carbono asimétrico o quiral. Este hecho hace que el gliceraldehido exista en dos estructuras espaciales que se diferencian por cierta propiedad física (actividad óptica): una tiene el hidroxilo del C-2 hacia la derecha (D-gliceraldehido) y la otra posee el hidroxilo del C-2 hacia la izquierda (L-gliceradehido).
Las moléculas que aún teniendo la misma composición química tienen diferentes propiedades se denominan isómeros. A isómeros que se diferencian por la disposición espacial de los grupos sustituyentes de un centro quiral se les conoce con el nombre de isómeros ópticos o estereoisómeros. Dichos isómeros ópticos presentan una propiedad física denominada actividad óptica. La actividad óptica es la capacidad que tienen las moléculas quirales, en disolución, de desviar el plano de un haz de luz polarizada. Si lo hacen en el sentido de las manecillas del reloj, se designan con el símbolo (+) y si lo hacen en sentido contrario se designan con (-). Así, el enantiómero D- del gliceraldehido es (+) y el L- es (-). Esto no quiere decir que todos los monosacáridos de la serie D tengan que ser (+). Por un lado está la posición del grupo hidroxilo (-OH) respecto a su carbono quiral, que es un aspecto puramente estructural, y por otro el efecto de la estructura de la molécula sobre el haz de luz polarizada, que es producido por la interacción de los rayos de luz polarizada con la red cristalina de la molécula en disolución. Por la configuración de los sustituyentes de los carbonos quirales no es posible asignar a un carbohidrato actividad óptica (+) ó (-).
Cuando los isómeros ópticos son imágenes especulares no superponibles se denominan enantiómeros, como es el caso del D y L gliceraldehido (Figura 4). Aquellos isómeros ópticos que se diferencian solo en la configuración de uno de sus carbonos quirales se denominan epímeros. El resto de isómeros ópticos que no son enantiómeros ni epímeros se denominan diastereómeros.
Los monosacáridos se clasifican en la serie D- o en la serie L- de acuerdo con la configuración del carbono quiral más alejado del grupo carbonilo. Así, si dicho carbono posee la misma configuración que el carbono quiral del D-gliceraldehido, pertenece a la serie D-.
En la Figura 5 se recogen las aldosas de la serie D-. Como se observa podemos construirlas adicionando unidades de H-C-OH ó de HO-C-H inmediatamente por debajo del carbono carbonílico. Lógicamente existirá otra familia de la serie L- con las imágenes especulares de las aldosas de esta Figura. En total tendremos 2 aldotriosas, 4 aldotetrosas, 8 aldopentosas y 16 aldohexosas.
En las cetosas el grupo carbonilo ocupa la posición 2 en la cadena carbonada. La cetosa más pequeña es la dihidroxiacetona:
Lo primero que salta a la vista es que esta cetosa carece de carbono quiral, luego, a diferencia de las aldosas, sólo existe una ceto-triosa y carece de actividad óptica. De ella se continúa la familia con la Eritrulosa, la cual sí posee enantiómeros D- y L-, ya que el carbono 3 es quiral (posee 4 sustituyentes distintos). La Figura 6 muestra las cetosas de la serie D-. Existen 1 cetotriosa, 2 cetotetrosas, 4 cetopentosas y 8 cetohexosas. De todas ellas la cetosa más común es la D-fructosa, cuyo nombre se le asignó antes de conocer su estructura; el resto de cetosas se aislaron o sintetizaron a partir de las aldosas y se las denominan basándose en el nombre de su aldosa de origen. Así, la D-fructosa, debería llamarse D-arabinohexulosa, ya que posee el esqueleto base de la D-arabinosa.
3. Reacciones de ciclación de los monosacáridos
La presencia de cinco o de seis carbonos en la cadena proporciona a estos compuestos la posibilidad de formar estructuras de anillo muy estables mediante la formación de un enlace hemiacetal interno, en el caso de las aldosas, o un hemicetal interno si son cetosas.. La formación de la estructura cíclica se produce de la misma manera que los alcoholes reaccionan con los grupos carbonilo de aldehídos o las cetonas.
El grupo hidroxilo de un monosacárido puede reaccionar con su correspondiente grupo carbonilo (aldo- o ceto-) para dar lugar a hemiacetales o hemicetales cíclicos. Este tipo de procesos se puede representar mediante las fórmulas de proyección de Haworth. Las proyecciones derivadas de aldosas de seis carbonos dan lugar a anillos derivados de pirano y las derivadas de cetosas de seis carbonos originan anillos derivados de furano (Figura 8).
Así, por ejemplo, la D-Glucosa se cicla por reacción del hidroxilo del carbono 5 (C-5) con el grupo carbonilo del aldehido, dando lugar a un anillo hexagonal de piranosa, por similitud con el anillo de pirano (Figura 9).
Un aspecto importante del proceso es que al formarse el correspondiente hemiacetal, el C-1 de la glucosa (que inicialmente era no quiral) se transforma en un carbono quiral (con 4 sustituyentes distintos). Este nuevo carbono quiral recibe el nombre de anomérico (*), y da lugar a dos estructuras denominadas anómeros, uno con el grupo hidroxilo del C-1 por debajo del anillo, anómero , y el otro con el grupo hidroxilo por encima del anillo, anómero ß. Así, por ciclación de la D-glucosa obtenemos los hemiacetales -D-glucopiranosa y la ß-D-glucopiranosa.
-D-glucopiranosa D-glucosa -D-glucopiranosa
De la misma manera la D-fructosa se cicla por reacción del hidroxilo del carbono 5, con el carbonilo que ocupa la posición 2, dando lugar, en este caso, a un anillo de furanosa (por similitud con el anillo de furano), con dos anómeros; uno sería la -D-fructofuranosa y el otro la ß-D-fructofuranosa.
anillo de furano -D-fructofuranosa D-fructosa ß-D-fructofuranosa.
En general, las hexosas y las pentosas pueden adoptar la forma de pirano o furano dependiendo de la naturaleza del azúcar. Es importante indicar que en disolución acuosa existe un equilibrio entre la forma abierta y los anillos ciclados. De tal manera que la D-glucosa se presentaría en equilibrio entre su anómeros y .
4. Reacciones de oxidación-reducción
La oxidación de los monosacáridos puede producirse de diversas formas, según el agente oxidante utilizado. Así, la oxidación suave de una aldosa con Cu (II) produce los ácidos aldónicos, como en el ejemplo recogido en la Figura 10.
La reducción de aldosas en atmósfera de hidrógeno produce alditoles (polialcoholes). Así, la reducción de la glucosa conlleva la reducción del grupo carbonilo de naturaleza aldehídica para rendir un polialcohol conocido como sorbitol.
5. Reacción de formación de enlaces O-glucosídicos
Una de las reacciones más importantes de los monosacáridos es la reacción del carbono anomérico (del anillo de piranosa o furanosa) con un alcohol para producir un glucósido. El nuevo enlace que se forma recibe el nombre de enlace glucosídico. Así, la ß-D-glucopiranosa puede reaccionar con el etanol para dar el siguiente glucósido:
que recibe el nombre de ß-D-metil-glucopiranósido (se cambia la terminación -osa por -ósido).
La importancia de este proceso radica en que el enlace glucosídico se forma también por reacción del hidroxilo del carbono anomérico de un monosacárido con un grupo hidroxilo de otro monosacárido, dando lugar a un disacárido. Los oligosacáridos y los polisacáridos son el resultado de la unión de monosacáridos mediante este tipo de enlace.
En general este tipo de compuestos se conocen con el nombre de O-glucósidos (el oxigeno hace de puente en el enlace). Además existen otros glucósidos, de gran importancia en la naturaleza: se trata de los N-glucósidos, en los que el C anomérico reacciona con una amina. Tiene gran importancia en la formación de nucleósidos, entre ellos la adenosina es el más abundante, que forma parte del trifosfato de adenosina (ATP), y de los ácidos ribonucleicos.
6. Los Disacáridos
Son dímeros formados por dos moléculas de monosacáridos, iguales o diferentes, unidas mediante enlace glucosídico. Este enlace puede realizarse de dos formas distintas; tomemos como ejemplo la glucosa.
i) ii)
En el primer caso, i), los dos monosacáridos están unidos mediante enlace O-glucosídico del tipo (1-4); como se puede apreciar, el disacárido formado presenta un carbono anomérico (*) libre (en el anillo segundo). En el caso ii) la unión se establece a través de los carbonos anoméricos de ambos monosacáridos; en este caso, el enlace glucosídico es del tipo (1-1), bloqueando los dos carbonos anoméricos (*).
La Figura 11 muestra algunos disacáridos abundantes, la sacarosa, la lactosa, la maltosa y la trealosa. Vamos a analizar químicamente la lactosa y la sacarosa. La lactosa es el ß-D-galactopioranosil-(1-4)-ß-D-glucopiranosido, y la sacarosa es el -D-glucopiranosil-(1-2)-ß-D-fructofuranosido. La lactosa posee un enlace glucosídico ß-(1-4), mientras que en la sacarosa es del tipo (1-2)ß. Este aspecto es muy importante si se analizan sus propiedades químicas. Así, la lactosa al poseer un carbono anomérico libre (el C-1 de la glucosa), en disolución, puede abrirse y poner de manifiesto la naturaleza reductora de este disacárido. Por su parte la sacarosa, no posee carbono anomérico libre, los dos están formando parte del enlace glucosídico, ninguno de los anillos puede abrirse y pierde su capacidad reductora. Por esta razón se dice que la lactosa es un azúcar reductor y la sacarosa no.
7. Polisacáridos
Son polímeros de monosacáridos unidos por enlace O-glucosídico. Entre los polímeros naturales, algunos de los más abundantes y de mayor significativo biológico son el almidón, el glucógeno y la celulosa. Los tres están formados por moléculas de D-glucosa y sólo se diferencian en el tipo de enlace glucosídico, constituyendo estructuras espaciales diferentes.
• El almidón
Es la principal reserva de hidratos de carbono que sintetizan las plantas y es también la principal fuente de glucosa para la alimentación de los animales. Está formado por una mezcla de dos polisacáridos, la amilosa (en un 20 %) y la amilopectina (en un 80 %). La amilosa es un polímero lineal de D-glucosa con uniones -(1-4) glucosídicas (Figura 12), que le permite adoptar una disposición tridimensional de tipo helicoidal (Figura 13).
Por su parte, la amilopectina está constituida por restos de D-glucosa unidos por enlace -(1-4), pero presenta también ramificaciones cada 24-30 unidades de glucosa, mediante enlaces -(1-6) (Figura 13).
• El Glucógeno
El glucógeno es el polisacárido de reserva de glucosa en los animales y constituye el equivalente al almidón en las células vegetales. Se halla presente en todas las células, aunque preferentemente se acumula en los músculos esqueléticos y especialmente en el hígado (10 % en peso), en cuyas células el glucógeno aparece en forma de grandes gránulos. La estructura principal del glucógeno se parece a la amilopectina, posee una cadena líneal con uniones -(1-4) y ramificaciones -(1-6), aunque en este caso aparecen cada 8 ó 12 unidades de glucosa (Figura 15). El glucógeno (al igual que el almidón) se hidroliza con facilidad por la acción de las -amilasas (proteínas especializadas en la rotura del enlace -glucosídico).
• La celulosa
La celulosa, componente estructural primario de las paredes de las células vegetales, es un polímero lineal de glucosa unido por enlaces ß-(1-4) glucosídicos (Figura 16). A diferencia de la amilosa (helicoidal y con uniones ), el enlace ß impide que la molécula se enrolle, de forma que las cadenas de celulosa pueden adoptan una conformación plenamente extendida permitiendo que se empaqueten con facilidad mediante puentes de hidrógeno, lo que explica su resistencia y su insolubilidad en agua. A diferencia de los casos anteriores, los vertebrados no poseen enzimas capaces de hidrolizar el enlace ß-(1-4), sólo los herbívoros poseen microorganismos simbióticos con una enzima (celulasa) que permite hidrolizar los enlaces ß-(1-4) glucosídicos.
Otro polisacárido de gran abundancia en la naturaleza es la quitina, que es el principal componente estructural de los esqueletos de los invertebrados. La quitina es un polímero constituido por restos N-acetil-D-glucosamina unidos por enlace ß-(1-4). Se diferencia de la celulosa sólo en el sustituyente del C-2, que posee, en lugar de un -OH, una acetamida. De relevancia son también otros polisacáridos como la heparina, polisacárido heterogéneo natural compuesto por D-iduronato-2-sulfato unidos por enlace glucosídico (1-4) a N-sulfo-D-glucosamina-6-sulfato (Figura 17). Se utiliza en medicina por su poder anticoagulante. El ácido hialurónico es otro heteropolímero constituido por dímeros de ácido glucurónico y N-acetilglucosamina (Figura 18). Está presente en los fluídos sinoviales de las articulaciones donde desempeña su función protectora contra golpes, basada en su valor lubrificante y su alta viscosidad.
8. Funciones fisiológicas de los carbohidratos
Algunos monosacáridos como la glucosa y sus derivados, son piezas fundamentales de muchas rutas metabólicas esenciales para la obtención de energía . La glucosa actúa en el organismo como combustible energético de uso rápido, mientras polisacáridos o grasas son reservas energéticas que deben ser procesadas antes de su utilización. Algunos monosacáridos y disacáridos como la fructosa o la sacarosa son responsables del sabor dulce de muchos frutos, con lo que se hacen más atractivos a los agentes dispersantes de las semillas.
Los oligosacáridos, pequeñas cadenas poliméricas conteniendo entre 2 y 10 monosacáridos, aparecen normalmente formando parte de las glicoproteínas que ejercen importantes funciones reguladoras o de reconocimiento celular.
Los polisacáridos como almidón o glucógeno tienen funciones de reserva energética en plantas y animales, respectivamente. Otros polisacáridos tienen funciones estructurales. Ya hemos citado el caso de la celulosa, principal componente de las paredes celulares vegetales, que supone la mayor parte de la masa de la madera y el algodón en casi pura celulosa; y la quitina, principal componente del exoesqueleto de muchos artrópodos. También tienen gran importancia estructural el heteropolímero de residuos alternados de N-acetilglucosamina y N-acetilmurámico unidos por enlaces 1-4), que constituyen el componente principal de las paredes celulares bacterianas; estos heteropolímeros se unen a proteinas formando peptidoglucanos.
HIDRATOS DE CARBONO
Los monosacaridos se clasifican segun la naturaleza quimica de su grupo carbonilo y del numero de atomos que poseen.
Atendiendo a la naturaleza quimicadel grupo funcional carbonilico, si este es aldehido el monosacarido recibe el nombre generico de aldosa y si es cetonico el monosacarido se le designa como cetosa dependiendo del numero de atomos de carbonos de la celula los monosacaridos se denominan , triosas, tetrosas,pentosas,hexosas cuando contienen tres, cuatro, cinco seis etc. atomos de carbono . se conocen en la naturaleza monosacaridos de hasta 8 atomos de carbono. La combinacion de ambas nomenclaturas anteriores permite denominar con el termino aldoexosa a un azucar ( -osa) de seis atomos de carbono ( -hex-) cuyo carbono carbonilico es una aldosa ( aldo-) por ejemplo la glucosa .
El gliceraldehido es la aldosa mas simple . Esta formado por tres atomos de carbono, el primero tiene el grupo aldehido, el segundo tiene unido un hidrogeno y un grupo hidroxilo, mientras que el tercero posee dos hidrogenos y un hidroxilo, de los tres carbonos el segundo ( -2 ) posee los cuatro sustituyentes distintos y por esta caracteristica recibe el nombre de carbono asimetrico o quiral. Este hecho hace que el gliceraldehido exista en dos estructuras espaciales que se diferencian por cierta propiedad fisica ( actividad optica ): una tiene el hidroxilo del C-2 hacia la izquierda ( L- gliceraldehido ).
las moleculas que aun teniendo la misma composicion quimica tienen diferentes propiedades se denominan isomeros. A isomeros que se diferencian por la disposicion espacial de los grupos sustituyentes de un centro quiral se les conoce con el nombre de isomeros opticos o estereoisomeros dichos isomeros opticos presentan una propiedad fisica denominada actividad optica es la capacidad que tienen las moleculas quirales, en disolucion de desviar el plano de un haz de luz polarizado. si lo hacen en el sentido de las manecillas del reloj se designan con el simbolo ( +) y el L- es (- ) esto no quiere decir que todos los monosacaridos de la serie D tenga que ser ( + ) por un lado esta la posicion del grupo hidroxilo (- OH) respecto a su carbono quiral que es un aspecto puramente estructural y por otroel efecto de la estructura de la molecula sobre el haz de luz polarizada que es producido por la interaccion de los rayos de luz polarizada con la red cristalina de la molecula en disolucion por la configuracion de los sustituyentes de los carbonos quirales no es posible asignar a un candidato actividad optica ( + ) o (- ) Cuando los isomeros opticos son imagenes especulares no superponibles se denominan enantiomeros, como es el caso del D y L gliceraldehido.
Aquellos isomeros opticos que se diferencian solo en la configuracion
Suscribirse a:
Entradas (Atom)























